|
გულის
ვირუსული
დაავადებათა
ეტიოლოგიის
თავისებურებანი
ნ.
ყიფშიძე*,
მ.
როგავა*,
მ.
ღუდუშაური*,
ნ.
ბარნაბიშვილი**,
თ.
ბოჭორიშვილი* |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ОСОБЕННОСТИ ДИАГНОСТИКИ У БОЛЬНЫХ С ПОСТИНФАРКТНЫМ РЕМОДЕЛИРОВАНИЕМ ЛЕВОГО ЖЕЛУДОЧКА
Ю.Л. Шевченко, И.А. Борисов, А.Н. Блеткин Национальный Центр Грудной хирургии Национальный Медико-хирургический Центр имени Н.И. Пирогова МЗ РФ, Москва.
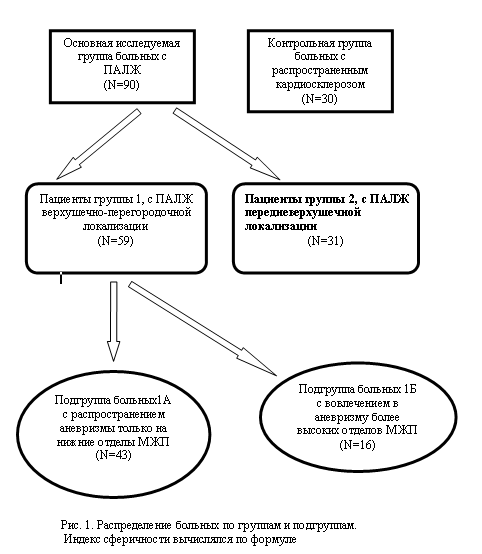
Цель следования: Ведущее место среди сердечно-сосудистых заболеваний занимает ишемическая болезнь сердца. Согласно данным ВОЗ в Европе, вследствие осложнений этого заболевания, в 1998 году отмечалось более 600 000 смертных случаев. При этом с каждым годом увеличивается не только рост показателя заболеваемости, но и частота повторных инфарктов миокарда (в среднем на 2%). «Выключение» части миокарда из эффективной работы сердца, в результате острого инфаркта миокарда приводит к значительным изменениям массы, формы и размеров полостей сердца, снижению силы сокращения левого желудочка. Некроз кардиомиоцитов и активация каскада биохимических реакций, возникающие в раннем постинфарктном периоде, обуславливают значительные изменения механических свойств тканей. Дальнейшее ремоделирование левого желудочка характеризуется расширением полости и патологическим контуром левого желудочка, ведет к выраженной систолической и диастолической дисфункции, а прогрессивное ухудшение работы левого желудочка объясняется продолжающимся вовлечением в процесс ремоделирования миокарда в области «переходной зоны». Изменение конфигурации левого желудочка ведет к развитию новых условий внутрисердечной гемодинамики. При каждой систоле, за счет парадоксальных движений стенок, в полости желудочка образуется остаточный объем крови, что снижает ударный объем и сердечный индекс [15]. Этот процесс особенно выражен при постинфарктной аневризме левого желудочка с вовлечением межжелудочковой перегородки. Вовлечение в процесс межжелудочковой перегородки и задней стенки значительно ускоряет развитие геометрических изменений и снижает сократительную способность всего миокарда до критического уровня. [14, 20]. Компенсаторно развивающаяся гипердинамическая реакция невовлеченных в процесс сегментов (обычно базальных) ведет, в свою очередь, к дополнительному растяжению стенок желудочка. Помимо увеличения конечно-диастолического объема, происходит истончение стенки желудочка, что вместе с увеличением постнагрузки (за счет дилятации), приводит к еще более значительному снижению сердечного выброса. Таким образом, в основе быстрого прогрессирования недостаточности кровообращения при формировании постинфарктной аневризмы лежат два основных механизма: функциональное нарушение миокарда левого желудочка, индуцированное его ишемией, и его ремоделированием (с учетом анатомии аневризмы). Этим объясняется, что при естественном течении заболевания прогноз крайне неблагоприятен: выживаемость больных с постинфарктной аневризмой левого желудочка в течение 5 лет составляет 12% - 50%. В большинстве случаев развитие аневризмы левого желудочка является следствием ишемической болезни сердца и наиболее частым механическим осложнением острого инфаркта миокарда [12]. Однако все более частое выявление неклассических форм постинфарктной аневризмы левого желудочка с характерными признаками дискинезии и наличием обширных акинетичных рубцовых полей на фоне значительного снижения сократимости, делают крайне необходимым изучение ряда характеристик и показателей ремоделирования левого желудочка. Поэтому для выбора оптимальной тактики и прогнозирования конечного результата предполагаемого лечения важна своевременная диагностика этого грозного осложнения ишемической болезни сердца. При тщательном сборе анамнеза, первичном клиническом осмотре и анализе электрокардиограммы (12 стандартных отведений) диагноз постинфарктная аневризма левого желудочка может быть вынесен в 70%-79% случаев, несмотря на низкую специфичность каждого метода в отдельности. Патогноничные признаки для аневризмы левого желудочка при анализе электрокардиограммы не выявляются. Наличие же широких зубцов Q и элевация зубцов ST, сохраняющиеся более 2- х недель после окончания острой фазы инфаркта миокарда, может наводить на мысль о формировании аневризмы [5, 17]. По данным N. L. Mills (1975), элевация сегмента ST отмечалась лишь у 62% пациентов с выраженной асинергией передневерхушечной области левого желудочка [28]. При более поздних исследованиях авторы указывают, что чувствительность ЭКГ, записанной в 12 стандартных отведениях, остается на уровне 41%-57,6%, с относительно сходной специфичностью изменений ST сегмента 80,6%-85% [6]. Казуистическими считаются случаи когда аневризма левого желудочка выявляется случайно и не сопровождается клиническими проявлениями. Заподозрить наличие постинфарктной аневризмы левого желудочка только на основании рентгенологического исследования возможно лишь в отдельных случаях при выявлении характерного выпячивания тени левого желудочка и признаков недостаточности кровообращения по малому кругу [6]. Изолированно от других методов обследования, дополняющих клиническую картину заболевания, этот метод обычно мало информативен. Применение “золотых стандартов” диагностики, таких как: контрастная вентрикулография, эхокардиография и стресс- эхокардиография, позволяет с высокой степенью достоверности (в 94 % случаев) определить форму постинфарктной аневризмы левого желудочка. Кроме того, с помощью вышеперечисленных методов диагностики определяют локализацию, размеры, наличие тромботических масс в полости левого желудочка, оценивают кинетику его стенок, типы асинергии и сегментарное состояние сократимости, а также выраженность митральной недостаточности и ее генез [5, 17]. Сократительная функция миокарда – один из важных клинических и прогностических показателей у больных ишемической болезнью сердца. Интегральным показателем сократительной способности миокарда является фракция выброса (ФВ) левого желудочка. Двухмерная эхокардиография, позволяющая визуализировать весь левый желудочек, адекватно оценить его функциональное состояние, стала методом выбора при диагностике постинфарктной аневризмы левого желудочка. По данным ряда авторов, при снижении показателей сократимости миокарда (ФВ =20%) и выраженности асинергии в клинической картине резко возрастает процент сопутствующей недостаточности кровообращения (до 100%) [14]. Доплеровское сканирование позволяет определить турбулентный, часто маятникообразный поток крови в полости аневризмы. Возникновение турбулентного кровотока в полости левого желудочка и полости аневризмы ведет к образованию внутриполостных пристеночных тромбов, которые определяются до операции лишь в 45% (183)- 50% случаев [11]. Частота образования тромбов, в свою очередь, зависит от ряда факторов: величины инфаркта (в 93% случаев при обширном инфаркте миокарда), локализации (при передней локализации в области передней стенки левого желудочка в два раза чаще, чем при локализации в области задней стенки). При повторных инфарктах встречаемость внутриполостных тромбов составляет 49%-50% [5, 35]. Степень организации тромба обычно неодинакова, при длительном существовании аневризмы могут встречаться участки кальциноза. [35]. «Находки», в виде пристеночного тромбоза, по данным, во время операции составляют до 64% случаев. Помимо характеристики самой аневризмы, выявления патологических потоков, эхокардиография позволяет оценить сократительную способность базальных отделов, имеющую большое прогностическое значение при определении тактики лечения. Двухмерные измерения по малым диаметрам, оценивающие размеры левого желудочка с исключением аневризмы, помогают получить наиболее полное представление о сократимости как желудочка в целом, так и каждой отдельной стенки и ее сегментов. Фракция выброса, диспропорционально сниженная по отношению к размерам несокращающейся части стенки левого желудочка, может указывать на генерализованное поражение миокарда, преобладающее над региональной сократимостью [23]. Результаты эхокардиографии имеют высокую степень корреляции с результатами рентгеноконтрастной вентрикулографией. Основные признаки постинфарктной аневризмы левого желудочка, определяемые при вентрикулографии, основаны на визуальной оценке нарушений подвижности стенки левого желудочка в виде «парадоксальной систолической экспансии или акинезии». При наличии тромба в полости желудочка, вентрикулографическая картина может несколько изменяться, и отсутствие парадоксальной пульсации компенсируется (в диагностическом плане) наличием классических признаков внутриполостного тромба [3]. Однако, наиболее полную информацию о характере и степени анатомических изменений, возникающих в сердце при этой патологии, позволяет получить сравнение данных вентрикулографии и коронарографии [17]. При анализе результатов селективной коронарографии и вентрикулографии выявлено, что локализация аневризмы коррелирует с атеросклеротическим поражением венечных артерий. Аневризмы передней и боковой стенок формируются в основном при окклюзии передней межжелудочковой артерии и диагональной артерии. При проксимальных же поражениях передней межжелудочковой артерии происходит формирование передне-перегородочной формы аневризмы. У 66% пациентов с аневризмой левого желудочка передней локализации передняя межжелудочковая артерия была окклюзирована, у 24% отмечался стеноз более 70%, у 10% --стеноз менее 70%. Так как большинство аневризм левого желудочка, выявляемых при обследовании, являются следствием значительного поражения венечного русла, состояние венечных артерий является одним из самых важных моментов при прогнозировании как ближайшего, так и отдаленного результатов лечения. При постинфарктной аневризме левого желудочка в последние десятилетия все чаще отмечается многососудистое поражение коронарного русла (частота двух и трех сосудистого поражения составляет 82-90% [27]). Ряд авторов отмечает в 22% случаев однососудистое поражение, а в 50% -трехсосудистое или стволовое поражения левой коронарной артерии [24]. Определение объема поражения коронарного русла играет и большую прогностическую роль в определении риска при определении хирургической тактики лечения: при 4-х сосудистом поражении коронарного русла отмечалась 20% госпитальная смертность, 3-х сосудистом - 15%, 2-х – 7% [24]. Однако, существуют определенные недостатки рентгеноконтрастных методов исследования: недостаточная точность при вынесении диагноза (при однопроекционной вентрикулографии), инвазивность (катетеризация камеры левого желудочка), лучевая нагрузка на пациента, высокие дозы рентгеноконтрастных препаратов при многопроекционной вентрикулографии, возможность возникновения нарушений ритма и увеличение КДО при быстром одномоментном введении контраста. Некоторые исследователи также считают что нецелесообразно основываться только на данных вентрикулограммы при прогнозировании исхода оперативного лечения. По данным S. Oxelbark (1993) чувствительность вентрикулографии в диагностике тромба в полости левого желудочка составила около 24% [31]. Кроме того, при операции аневризма обнаруживается лишь у 78% пациентов, у которых ранее определялась при вентрикулографии. В случае же непереносимости пациентом рентгеноконтрастных веществ метод вообще противопоказан. Вследствие этого, научный поиск многих исследователей направлен на разработку методов диагностики, не уступающих в информативности вентрикулографии, но лишенных ее отрицательных сторон. В то же время, увеличение объема оперативных вмешательств по поводу ишемической болезни сердца, все более частое выявление неклассических форм постинфарктной аневризмы левого желудочка с характерными признаками дискинезии и наличия, обширных акинетичных рубцовых полей, на фоне значительного снижения сократимости, делают крайне необходимой дифференциальную диагностику функционального и морфологического состояния миокарда [1, 14, 26]. В зависимости от степени гибернации миокарда в парарубцовой зоне, может меняться и тактика лечения. Поэтому исследование обратимости дисфункции миокарда становится все более актуальным. Одним из самых распространенных методов стала стресс-эхокардиография (стресс-ЭхоКГ) с фармакологическими нагрузками (добутамином, нитроглицерином, дипиридамолом), а также черезпищеводная электрокардиостимуляция (ЧПЭС) [1, 4]. Все виды стресс–ЭхоКГ дают ответы на одни и те же вопросы, хотя и полученные различными путями. При пробах с нитроглицерином и дипиридамолом за счет увеличения коронарного кровотока наблюдается восстановление функции асинергичных сегментов. Развитие сердечной недостаточности после инфаркта миокарда в большой степени зависит от изменения объема, формы левого желудочка и протяженности рубцового замещения миокарда. Состояние сократительной способности жизнеспособного миокарда занимает одно из ключевых положений в прогностическом плане [2]. Недостаточно перфузируемый миокард может характеризоваться парадоксальным движением в систолу, что исчезает после его реваскуляризации. По данным экспериментальных и клинических исследований были описаны несколько взаимосвязанных патофизиологических феноменов, лежащих в основе приходящей дисфункции миокарда, которые стали известны как «оглушение» и «гибернация» [8, 32]. “Оглушение”, или перфузионный парадокс , является одной из форм острого реперфузионного повреждения миокарда, при котором поступление кислорода в гипо- или аперфузируемую зону вызывает транзиторное нарушение механизма сокращения за счет перегрузки кардиомиоцитов кальцием [33]. «Гибернация» или «спящий миокард» - это адаптивный, активно-регулируемый процесс обратимой дисфункции миокарда, развившийся на фоне хронической гипоперфузии при отсутствии клинических проявлений ишемии [33]. Роль жизнеспособности миокарда в инфарцированной зоне до сих пор не до конца определена. Данные, собранные различными авторами, свидетельствуют, что наличие жизнеспособного миокарда, выявляемого при тестах с низкими дозами добутамина, может увеличивать защитный эффект от ремоделирования и увеличения объема желудочка, а также потенциально увеличивать возможность раннего функционального восстановления «оглушенного миокарда». На современном уровне развития медицины радионуклидная диагностика является наиболее информативной и позволяет выявить широкий спектр биохимических, морфологических и функциональных изменений в миокарде и остается приоритетной в определении наличия обратимой дисфункции миокарда и ее степени. Наибольшее распространение получили позитронно эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОЭКТ), радионуклидная равновесная вентрикулография, томовентрикулография, и т.д. [10, 16]. Эти методы, основанные на применении кардиотропных препаратов, меченных фотон-излучающими элементами, позволяют изучать, как региональный кровоток или перфузию, так и метаболизм используемых препаратов. С их применением стало возможным не только адекватно оценить тяжесть патологических процессов в сердечной мышце, но и моделировать динамику восстановления насосной функции миокарда, прогнозировать как гемодинамический, так и клинический исход лечения [8]. Материалы и методы: Нами представлен анализ результатов обследования 90 больных с постинфарктной аневризмой левого желудочка: 87 мужчин и 3 женщин в возрасте от 31 года до 75 лет за период с 2000-2005 гг Все исследуемые больные были подразделены на две группы. В группу 1 были объединены 59 больных с локализацией постинфарктной аневризмы в верхушечно-перегородочной зоне левого желудочка (рис. 1). Характерной особенностью для этой группы было значительное вовлечение в аневризму нижних отделов межжелудочковой перегородки. Группу 2 составил 31 пациент, у них постинфарктная аневризма захватывала только передневерхушечную зону левого желудочка, т.е. у больных этой подгруппы межжелудочковая перегородка была интактна. При более тщательном анализе клинической картины и данных инструментального исследования выявлено, что клиника заболевания, методы оперативного воздействия и результаты лечения во многом зависят от степени вовлечения в рубцовый процесс межжелудочковой перегородки. В связи с этим, пациенты группы 1 были разделены в свою очередь на две подгруппы: 1А и 1Б. В подгруппу 1А объединены 43 пациента, для них было характерно распространение аневризмы только на нижние отделы межжелудочковой перегородки (рис. 1). Другими словами - рубцовый процесс, вследствие перенесенного инфаркта захватывал межжелудочковую перегородку менее чем на половину ее длины. Подгруппу 1Б составили 16 пациентов с вовлечением в аневризму более высоких отделов межжелудочковой перегородки, то есть с распространением рубцовых тканей более чем на половину длины межжелудочковой перегородки (рис. 1). По данным анамнеза (длительность заболевания, число перенесенных острых инфарктов миокарда и т.д.), а также основным жалобам и клиническим проявлениям заболевания, пациенты обеих групп существенно не различались. Одним из важнейших элементов диагностики была эхокардиография, которая проводилась всем пациентам исследуемых групп. Исследования выполнялись в М и В режимах на аппаратах фирмы «Toshiba» Power Vision 8000 SSA 390 A и «Hewlett Packard» Sonos 100, с частотой датчиков 2,5-3,5 МГц. Селективная много проекционная коронарография и левая рентгеноконтрастная вентрикулография выполнялись на ангиографических установках фирм «Toshiba» и «Siemens». Исследование выполнялось по методу M. Judkins (1967), с ретроградным введением катетера после пункции бедренной или лучевой артерии по S. Seldinger. Данные записывались на VHS видеопленку и компьютерные диски (CD). Особое внимание обращали на качественный и количественный анализ асинхронии региональной кинетики стенок левого желудочка, степень нарушения геометрических и стереометрических показателей, изменения сократительной способности миокарда. При вентрикулографии и эхокардиографии кинетика стенок ЛЖ оценивалась с использованием индекса сократимости. Состояние локальной сократимости каждого сегмента миокарда ЛЖ оценивалось по 5 бальной шкале: 1-нормокинезия , 2- умеренная гипокинезия, 3- выраженная гипокинезия, 4- акинезия, 5- дискинезия Учитывались следующие показатели систолической и диастолической функции левого желудочка (ЛЖ): конечно-диастолической объем (КДО), конечно-систолический объем (КСО), ударный объем (УО), и их индексы (по отношению к поверхности тела), экскурсии межжелудочковой перегородки (МЖП) и задней стенки левого желудочка (ЗСЛЖ), наличие и тип диастолической дисфункции. Для оценки изменений геометрических показателей левого желудочка (ЛЖ) рассчитывались: индекс сферичности (ИС ЛЖ), индекс относительной толщины стенки ЛЖ (2H/D), H толщина стенки, D диаметр в диастолу.
Индекс сферичности вычислялся по формуле
√L² - D²
L. (13), где L – длина левого желудочка по длинной оси; D – длина левого желудочка по короткой оси. Для оценки жизнеспособности миокарда в целом («миокардиальный резерв»), степени его гибернации в прилежащих к аневризме участков больным выполняли однофотонную эмиссионную томосцинтиграфию миокарда (ОЭКТ) томографии с 99мТс-метоксиизобутилизонитрилом (МИБИ), активностью 370-555МБк, в объеме 0,3-0,6 мл в покое и с нагрузочным тестом добутамином (малыми дозами). Томографическое исследование проводили на двухдетекторной гамма-камере “Millenium MG”, через 40-50 минут после внутривенного введения 99мТс-МИБИ в покое или на пике нагрузочной пробы. Обработка информации выполнялась на рабочей станции “Genie” 2001 “General Electric” с использованием программы “Cequal”. По результатам сцинтиграфии определяли наличие, локализацию, характер и величины дефектов перфузии, средний процент аккумуляции индикатора в секторах с уменьшенной концентрацией радиофармпрепарата (процент накопления), индекс дефектов перфузии. С целью оценки наличия жизнеспособного миокарда в «переходной» ишемизированной зоне выполнялась сцинтиграфия миокарда с нагрузочной пробой добутамином (НПД) в дозе 3,5-4,5 мкгр /кг /мин, в течение 10-15 мин. При введении добутамина возможно возникновение локальной дисфункции миокарда. У больных во время эхокардиографии с нагрузкой добутамином инфаркт миокарда развивается у 0,1% исследуемых, устойчивая тахиаритмия и фибрилляция желудочков - 0,4% и 0,2% соответственно. Поэтому перед проведением исследования все пациенты предупреждались о потенциальном риске. Исследование проводилось в присутствии реаниматолога в специально подготовленном помещении. Во время исследования также проводился постоянный мониторинг электрокардиограммы, артериального давления, частоты сердечных сокращений, Sat 02. Исследование прекращалось в случае появления нарушений ритма, подъема значений (от исходных) артериального давления более чем на 20 мм рт ст, появления болевого синдрома, депрессии или элевации сегмента ST более чем на 2 мм. Статистическую обработку данных материалов исследования производили с применением статистической программы электронных таблиц Microsoft Excel XP и пакета программ Statistica 6.0. Результаты исследования: В целом, клиническая картина у всех пациентов укладывалась в описание Р. Горлина (1980): «Больные с аневризмой сердца могут страдать застойной недостаточностью кровообращения, стенокардией, рецидивирующими пароксизмами тахикардии …» [3]. Обращает на себя внимание тот факт, что боли в области сердца и за грудиной при физической нагрузке отмечали все пациенты, то есть у всех была клиника стенокардии. Согласно классификации NYHA все пациенты в обеих группах относилось к 3-4 ф.к. На прогрессирующий характер стенокардии указывали 24 пациента (26,7%) в 1 группе: 15 (34,9%) больных в 1А, 9 (56,3%) в 1Б подгруппах соответственно, и 10 (32,3)% пациентов - во 2 группе. Наряду с этим клиническую картину заболевания характеризовала и во многом утяжеляла имевшая место недостаточность кровообращения. В большинстве пациенты 1 группы поступили в клинику с явлениями сердечной недостаточности, развившейся в различные сроки после перенесенных ОИМ (от 1 до 34 месяцев, в среднем 12,6 месяца). Признаки декомпенсации кровообращения при поступлении отмечены у 24(55,8%) пациентов в 1А подгруппе, а также у всех больных в 1Б подгруппе и только у 14 (45,2%) пациентов второй группы. Это было подтверждено и при рентгенологическом исследовании. Смешанный тип застоя по гиперволемическому типу достоверно больше отмечался в группе 1 (67,8%), чем в 2 (45,2%) группе (р<0,05). По данным эхокардиографии снижение сократимости левого желудочка отмечалось у всех пациентов (таблица №2). В зависимости от объема и характера поражения стенки левого желудочка имели как дискинетичные, так и акинетичные сегменты. Среднее число сегментов на одного пациента, охарактеризованных, как акинетичные и дискинетичные, было достоверно больше в группе 1 (с перегородочной формой аневризмы). Нарушения кинетики стенок левого желудочка были наиболее выражены у больных в 1Б подгруппе, с парадоксальным движением межжелудочковой перегородки более чем половины ее длины. Наибольший размер основания аневризмы был отмечен также у пациентов 1Б подгруппы (таблица №1). Как видно из приведенных в таблице №2 данных, достоверное уменьшение значений общей фракции выброса (до 29%) отмечено в группе пациентов 1Б. Сравнительный анализ фракции выброса не вовлеченных в аневризму сегментов (локальная фракция выброса) также указывает на значительное нарушение сократимости у больных с распространением аневризмы на межжелудочковую перегородку более половины ее длины. Общеизвестно, что развитие аневризмы приводит к изменению объема полости левого желудочка. В обеих группах больных отмечено увеличение объемных характеристик левого желудочка (таблица №3). Так, наибольший КДО отмечался в группе 1Б и в среднем был 214,7 мл, а КСО в подгруппе в среднем составил 142,5мл. Однако статистически достоверных различий между показателями в 1А и 2 группах не выявлено. Расширение полости левого желудочка, наиболее выражено в группе 1Б . Таблица №1. Размер и локализация постинфарктных аневризм.
Таблица №2. Фракция выброса у пациентов с ПАЛЖ.
Таблица №3. Характеристика объемных показателей
* различие достоверно между 1А и 1Б группами ** различие достоверно между 1Б и 2 группами При оценке геометрических показателей в подгруппе 1Б при наибольшем увеличении значений длины и диаметра желудочка как в систолу, так и в диастолу, сферичность его полости в обе фазы сердечного цикла значительно не изменялась, т.е. форма полости сохранялась относительно элипсообразной. Наряду с этим, в подгруппе 1Б имелись наиболее низкие значения процента укорочения вдоль длинной и поперечной осей (4,82% и 8,1% соответственно), а также была уменьшена относительная толщина стенки желудочка (0,29) Это позволяет предположить значительно возросшее напряжение стенки левого желудочка и ее жесткости. Возросший комплайнс левого желудочка, увеличение объемных характеристик, на фоне значительного снижения сократительной способности миокарда, говорит о выраженном процессе ремоделирования левого желудочка и значительной инвалидизации миокарда у больных группы 1Б. Аналогичные, но менее выраженные изменения отмечены и подгруппе 1А. У больных группы 2, при наименьших показателях увеличения размеров левого желудочка, в систолу полость приобретает шарообразную форму (т.е. стремиться к сфере), больше чем в диастолу, другими словами желудочек при сокращении становиться сферичным, а при расслаблении элипсообразным. В этой группе за счет преимущественного вовлечения в аневризму переднебоковых сегментов уменьшено укорочение вдоль длинной оси, при относительно неизмененном укорочении в поперечном направлении. Относительная толщина левого желудочка в этой группе в среднем составила 0,4. Изменения объема и сократимости левого желудочка у больных в группе 2 (172,5мл, 99,8мл, 41% соответственно), выраженность ремоделирования левого желудочка, говорят о меньшей степени инвалидизации миокарда по сравнению с 1 группой пациентов. По данным селективной коронарографии у больных имело место как мультифокальное поражение венечного русла, так и изолированное с локализацией в передней межжелудочковой артерии. Однако при любом виде поражения имели место или окклюзия или гемодинамически значимый стеноз передней межжелудочковой артерии, что и обусловливало развитие постинфарктной аневризмы левого желудочка. При этом в группе 1Б у всех больных отмечалось поражение проксимальных отделов артерии (проксимальнее отхождения первой перегородочной ветви), чем объяснялось значительное поражение межжелудочкой перегородки. В исследуемых группах чаще встречался правый тип кровоснабжения сердца (52,2%), что приводило к раннему формированию перетоков в бассейн левой коронарной артерии, и являлось причиной снижения уровня смертности при остром трансмуральном передне-перегородочном инфаркте миокарда. По тяжести поражения венечного русла в группе 1А большинство пациентов имело 2-3-хсосудистое поражение (65,1%), в группе1Б – 3-х сосудистое поражение (50%), в группе 2 – 2-х сосудистое поражение (55%) Перед выполнением рентгеноконтрастной вентрикулографии всем больным осуществлялось измерение конечно-диастолического давления в левом желудочке (КДД). Наибольшее значение КДД отмечалось в подгруппе 1Б (15,7 мм рт ст), что свидетельствует о значительно возросших жесткости и напряженности стенок левого желудочка в диастолу, а в целом, о выраженности нарушения диастолической функции и ремоделировании левого желудочка. Сравнительный анализ данных инвазивного исследования с неинвазивными методами существенных и статистически достоверных различий не выявил.У 27 пациентов первой группы наличие постинфарктной аневризмы левого желудочка также было подтверждено методом равновесной радионуклидной вентрикулографии. Сравнительный анализ показателей сократительной функции миокарда левого желудочка указал на достоверное снижение общей фракции выброса у пациентов 1 группы, по сравнению с 2-ой группой (27% и 38,8% соответственно) 27 больным обеих групп выполнялась ОЭКТ в покое и с нагрузочной пробой добутамином. Наибольшее поражение миокарда у пациентов с постинфарктной аневризмой левого желудочка отмечается в области верхушки, передней стенки и передней части межжелудочковой перегородки. На основе данных ОЭКТ передневерхушечная локализация с распространением на межжелудочковую перегородку (МЖП) была подтверждена у 16 больных, а аневризма переднебоковой локализации без распространения на МЖП - у 11 больных, что коррелировало с данными, полученными во время эхокардиографии и вентрикулографии. При проведении томосцинтиграфии у больных с постинфарктной аневризмой левого желудочка определялся дефект перфузии в 67,5% сегментов при исследовании в покое и в 48,8% при нагрузочном тесте с добутамином. Постоянные дефекты перфузии определялись в девятнадцатом и двадцатом сегментах (88,9% и 92,5% сегментов были признаны не жизнеспособными). В пятом и шестом сегментах жизнеспособными были признаны в 55,5% и 51,8% соответственно. В третьем и четвертом сегментах постоянный дефект перфузии отмечался в 40,7%. Критический же уровень накопления радифармпрепарата был зарегистрирован в 40,7% сегментов пациентов с ПАЛЖ при исследовании в покое, и в 31,2% при нагрузочной пробе с добутамином и нежизнеспособными признаны 19,4% сегментов. Обсуждение результатов: Проведенное исследование позволило выявить ряд особенностей, присущих больным с различной локализацией постинфарктной аневризмы левого желудочка. Для определения основных факторов, ухудшающих функциональное состояние системы кровообращения, было проведено сравнение показателей сократительной способности левого желудочка и геометрических изменений его полости во всех группах. Использовались данные эхокардиографии, рентгеноконтрастной и радионуклидной вентрикулографий. Наиболее значимое снижение насосной функции левого желудочка было выражено в подгруппе 1А пациентов с перегородочной локализацией аневризмы (ФВ общая 39%), и, особенно, с распространением более чем на половину длины МЖП, группа 1Б (ФВ общая - 29%). У пациентов с постинфарктной аневризмой передневерхушечной локализации отмечалось снижение сократительной способности миокарда близкое к значениям в группе 1А (ФВ общая –41%). Увеличение объемных характеристик левого желудочка отмечалось у всех больных. Однако, в группе 1Б кроме максимального увеличения объема левого желудочка (КДО 214,7±33 мл, КСО 142,5±12 мл) отмечались также наибольшие значения конечно-диастолического давления (в среднем 15,7±3,7 мм. рт. ст.). Все это позволяет с достаточно высокой степенью достоверности говорить о значительном увеличении напряжениястенки левого желудочка («миокардиальный стресс»), увеличении пред- и постнагрузки на левый желудочек. Прогноз развития сердечной недостаточности у пациентов перенесших острый инфаркт миокарда зависит от изменения объема и формы левого желудочка [9]. Для описания процессов приводящих к нарушению функции левого желудочка в постинфарктном периоде был введен термин «постинфарктное ремоделирование левого желудочка» [9]. Наиболее выраженным процесс ремоделирования развивается у больных с формирующейся постинфарктной аневризмой левого желудочка. Несмотря на то, что проблема нарушения геометрии левого желудочка, вследствие острого инфаркта интересует хирургов с конца 50-х годов ХХ века (28), она и в настоящее время остается предметом пристального внимания [9, 11, 13, 27]. Исследования последних лет направлены на изучение роли строения левого желудочка, его механики и оценку значимости движения левого желудочка вдоль длинной и короткой оси при сокращении. [18, 19, 21, 34] В нашем исследовании нарушения геометрических соотношений определялись при выполнении эхокардиографии и вентрикулографии, а также интраоперационно. Наибольшие изменения геометрических параметров левого желудочка отмечались в группах 1А и 1Б, по сравнению с группой 2, причем, наибольшие нарушения внутриполостных соотношений были выявлены в группе с вовлечением в аневризму более ½ длины межжелудочковой перегородки (группа 1Б). Расширение полости желудочка вдоль длинной оси, как в систолу, так и в диастолу отмечалось во всех группах, расширение полости вдоль поперечной оси было выражено больше у группы 1 по сравнению с группой 2. Однако, при сравнении показателя укорочения левого желудочка отмечалось его значительное снижение вдоль длинной оси в подгруппе 1Б по сравнению с подгруппой 1А. При этом в целом группа 1 характеризовалась уменьшением процента укорочения по поперечной оси. Индекс сферичности и относительная толщина задней стенки левого желудочка как характеристики процесса ремоделирования имели наименьшие показатели в группе 1, и, особенно, в подгруппе 1Б. При оценке геометрических соотношений полости в группе 1 выявлены значительные изменения, свидетельствующие о выраженном ремоделировании левого желудочка: кроме увеличения значений объемных характеристик, снижения показателей ударного объема отмечается расширение полости желудочка, как по длинной, так и по поперечной осям, уменьшение относительной толщины задней стенки. Значения индекса сферичности свидетельствуют о тенденции к преобразованию элипсообразной формы желудочка в сферичную, как в период систолы, так и период диастолы. Увеличение конечно-диастолического давления на этом фоне свидетельствует о возрастающем напряжении стенки левого желудочка, увеличении преднагрузки, что в условиях снижения контрактильности, учитывая особенность кровоснабжения миокарда [3], ведет к ухудшению микроциркуляции миокарда и к еще большему нарушению трофики. В этих условиях поддержание перфузионного давления, по данным многих авторов, начинает происходить за счет компенсаторного роста общего периферического сопротивления (увеличение постнагрузки), что ведет к повышению потребления кислорода сердечной мышцей [22]. Дальнейшее снижение сократительной способности, сердечного индекса и дилятация полости приводят к декомпенсации механизма Франка-Старлинга и быстрому прогрессированию сердечной недостаточности. Этот процесс может значительно ускоряться при наличии значимой митральной недостаточности и вовлечении в аневризму значительной части межжелудочковой перегородки. В этом случае искажается механика движения желудочка в период напряжения (за счет дезориентации мышечных слоев, парадоксального движения перегородки). Это приводит к нарушению накопления и трансформации потенциальной энергии в кинетическую при следующей фазе систолы. Изменение внутрижелудочковой гемодинамики создает условия для развития турбулентности в полости левого желудочка, ведущее не только к быстрому росту напряжения стенки желудочка и возрастанию конечно-диастолического давления, но и к быстрому замыканию «порочного круга» и декомпенсации кровообращения. Турбулентные потоки крови вызывают механическое повреждение эндокарда и створок клапанов, что создает условия для развития тромбоэндокардита. Подавляющее большинство хирургов, учитывая гемодинамическую значимость вовлечения межжелудочковой перегородки в аневризму, не оценивает роль объема ее поражения. Проведенная с целью оценки жизнеспособности миокарда в целом («миокардиальный резерв»), степени его гибернации в прилежащих к аневризме участков, однофотонно эмиссионная томосцинтиграфия миокарда 99мТс-МИБИ в покое и с нагрузочным тестом добутамином (малыми дозами) помогла выявить, что нежизнеспособный миокард (в том числе и рубец) у пациентов с постинфарктной аневризмой левого желудочка локализовался в области верхушки, передней стенки передней части межжелудочковой перегородки. Это позволило важдом конкретном случае четко определить вовлечение межжелудочковой перегородки в патологический процесс и оценить степень ее жизнеспособности. Морфологически, перегородка левого желудочка может рассматриваться как часть левого желудочка, но это не совсем так, она вносит важный вклад в функцию обоих желудочков. V. S. Banka и соавторы (1981) исследовали движение межжелудочковой перегородки, и обнаружили, что перегородка утолщается одинаково в направлении обоих желудочков при одновременном сокращении вдоль продольной оси. J. B. Agarwal (1981) в экспериментальных работах доказал, что изолированная ишемия межжелудочковой перегородки ведет к систолической дисфункции обоих желудочков [29]. Во время диастолы, по мере увеличения конечно-диастолических давления и объема, перегородка смещается вправо, что повышает давление и в правом желудочке, а значит, увеличивает значение соотношения «объем - давление». Таким образом, левая половина сердца вносит значительный вклад в эффективность работы правого желудочка. R. J. Damiano и соавторы (1991) доказали, что левый желудочек и межжелудочковая перегородка ответственны более чем за 60% силы систолического сокращения правого желудочка [29]. При значительном поражении межжелудочковой перегородки, за счет дискинезии истонченной и фиброзно-перерожденной ее части, возникновения турбулентного тока крови и образования дополнительного остаточного объема, в систолу происходит выбухание рубцовой части перегородки в полость правого желудочка, вызывая его систолическую дисфункцию. В диастолу - повышение конечно-диастолических объема и давления, наряду с повышением жесткости стенок левого желудочка, создает условия для прогрессирования диастолической дисфункции правого желудочка. В результате этого развивается синдром Бернгейма [30]. Таким образом, гемодинамически значимая постинфарктная аневризма левого желудочка приводит к изменению внутрисердечной гемодинамики в целом, что обычно проявляется в быстром прогрессировании сердечной недостаточности. Наиболее неблагоприятную в прогностическом отношении группу составляли больные с вовлечением в постинфарктную аневризму более половины длины межжелудочковой перегородки (подгруппа 1Б). У этих пациентов отмечались достоверно наименьшие значения показателей сократимости миокарда, при достоверно наибольших размерах и объемах левого желудочка и выраженном процессе ремоделирования. Так как группы пациентов мало различались по клиническим проявлениям и длительности заболевания, можно предположить, что изменения сократительной функции левого желудочка и его геометрических параметров зависят от локализации аневризмы и степени вовлечения в нее межжелудочковой перегородки. Таким образом, становится ясно, что в основе недостаточности кровообращения у этой группы больных (группа 1) лежат два основных механизма: функциональное нарушение миокарда левого желудочка, индуцированное его ишемией и его ремоделированием (с учетом анатомии аневризмы). При этом наиболее тяжелой (с точки зрения клинического течения) и неблагоприятной (в прогностическом плане) подгруппой пациентов являются больные с вовлечением в аневризму межжелудочковой перегородки (более половины ее длины). Проведенные исследования показали гемодинамическую значимость постинфарктной аневризмы левого желудочка, особенно при ее распространении на межжелудочковую перегородку. При этом следует отметить, что длительно существующая аневризма способствует нарушению внутримиокардиальной гемодинамики (или перфузии миокарда), что также сказывается на функции миокарда в целом. Выводы: Определение выраженности асинергии стенок левого желудочка, количественная и качественная оценка жизнеспособности миокарда, как базальных отделов, так и в пограничной зоне, влияют не только на объем выполняемой прямой реваскуляризации миокарда. Эти показатели, в первую очередь, важны для предварительного определения уровня резекции аневризмы, вида пластики левого желудочка, прогнозирования возможных осложнений в раннем и отдаленном послеоперационных периодах. Поэтому для определения лечебной тактики у больных с постинфарктной аневризмой левого желудочка, диагностический поиск должен быть основан на тщательном сборе анамнеза, выявлении самой аневризмы, ее возможных осложнений и сопутствующей патологии. Крайне важным является оценка ряда факторов, позволяющих прогнозировать конечный результат предполагаемой тактики лечения. К ним относятся: I. Объем инфарцированого миокарда и степень организации рубца и . гибернации миокарда в парарубцовой зоне II. Локализация аневризмы и уровень вовлечения в ее состав МЖП.III. Изменения геометрии левого желудочка и механических свойств мышечной ткани. IV. Выраженность диастолической дисфункции левого желудочка. V. Состояние неинфарцированого миокарда. VI. Наличие осложнений развития аневризмы: аритмии, митральной недостаточности, внутрижелудочкового тромба. VII. Объем стенозирующего поражения венечного русла, оценка периферического русла. Однако, несмотря на то, что современный арсенал неинвазивных методов исследования значительно помогает в определении степени поражения миокарда, степени риска, в отношении выбора метода хирургического лечения и прогнозировании результатов, как правило, окончательное решение об объеме вмешательства принимается только после тщательной интраоперационной ревизии [25]. Литература: 1. Бузиашвили Ю.И., Асымбекова Э.У., Серов Р.А., Сигаев И.Ю. «Клинико-морфологические особенности обратимой дисфункции миокарда левого желудочка у больных ИБС.» // Анналы хирургии. - 1999. - №6 - с. 59-67. 2. Василидзе Т.В. «Хирургическое лечение постинфарктных аневризм левого желудочка.» М. - Дис. Д-ра Мед. Наук - 1985. 3. Горлин Р. «Болезни коронарных артерий.» М. - Медицина – 1980. 4. Шумаков В.И., Казаков Э.Н., Хубутия А.Ш. «Ишемическая кардиомиопатия: значение оценки жизнеспособности миокарда для определения показаний к АКШ или трансплантации сердца.» // Грудная и сердечно-сосудистая хирургия. -1999.- №6 – с. 11-15. 5. Ba’albaki H.A., Clements S.D. “Left Ventricular aneurysm: a review.” // Clin. Cardiol. -1989. - №12 – p. 5-13. 6. Benediktsson R., Eyjolfsson O., Thorgeirsson G. “Natural history of chronic left ventricular aneurysm; a population based cohort study.” // Jour. Clin. Epidemiol. - 1991.- №11 – р. 1131-1139. 7. Bolognese L., Cerisano G., Buonamici P., Santini A. “Influence of Infarct-Zone Viability on Left Ventricular Remodeling After Acute Myocardial Infarction.” // Circulation.- 1997. - №96 – р. 3353-3359. 8. BonowR.O. “Identification of viable myocardium.” // Circulation. -1996. – №94 – p. 2674-2680. 9. Buckberg G.D., Coghlan H.C., Torrent-Guasp F. “The structure and function of the helical heart and its buttress wrapping. Geometric concepts of heart failure and use for structural correction.”// Semin. Thorac.Cardiovasc.Surg. - 2001. - №13 - p.386-401. 10. Claeys M.J., Vrints C.J., Krug B., Bosmans J.M. “Adenosine Technetium-99 m sestamibi (SPECT) for the early assessment of jeopardized myocardium after acute myocardial infarction.” // Eur.Heart J. - 1995. - №16 – р. 1186-1194 11. Cooley D.A. “Management of left ventricular aneurysm by intracavitary repair.” // Operat. techniq. in cardiac thorac. sur. - 1997. - №2 – р. 151-161. 12. Di Donato M., Sabatier M., Dor V. “Akinetic versus dyskinetic postinfarction scar: relation to surgical outcome in patients undergoing endoventricular circular patch plasty repair.” // JACC. - 1997. - №29 – р. 1569-1575. 13. Di Donato M., Sabatier M., Dor V., Gensini G.F. “Effects of the Dor procedure on left ventricular dimension and shape and geometric correlates of mitral regurgitation one year after surgery.” // J.Thorac.Cardiovasc..Surg. - 2001. - №121- р. 91-96. 14. Dor V., Sabatier M., Di Donato M., Monteglio F., Toso A., Maioli M. “Efficacy of endoventricular patch plasty in large post-infarction akineticscar and severe left ventricular dysfunction: comparison with a series of large dyskinetic scars.” // J.Thorac.Cardiovasc.Surg. - 1998. – №116 – p. 50-59. 15. Elefteriades J.A., Solomon L.W., Mickleborough L.L., Cooley D.A. “Left ventricular aneurysmectomy in advance left ventricular dysfunction.” // Card.Clin. - 1995. – №13 – p. 59-72. 16. Flemeng W.J., Shivalkar B., Spiessens B., Maes A. “PET scan predicts recovery of left ventricular function after coronary artery bypass operation.” // Ann.Thorac.Surg. - 1997. – №64 – p. 1694-1701. 17. Friedman B., Dunn M.I. “Postinfarction Ventricular Aneurysms.” // Clin. cardiol. - 1995. – №18 – p. 505-511. 18. Henein M. Y., Gibson D. G. “Long axis function in disease.” // Heart. - 1999. – №81 - p. 229-231. 19. Ingels N.B. “Myocardial fiber architecture and left ventricular function.” // Technol. Health Care. - 1997. – №5 - p. 45-52. 20. Jatene A. “Left ventricular aneurysmectomy.” // Thorac. cardiovasc. sur. - 1985. - №89 - p.321-331. 21. Jones C.J.H., Raposo L., Gibson D.G “Functional importance of the long axis dynamics of the human left ventricle.” // Br.Heart J. - 1990. – №63 - p. 215-220. 22. Kawachi K., Kitamura S., Kawashima J. “Changes in myocardial oxygen consumption and coronary sinus blood flow before and after resection of left ventricular aneurysm after myocardial infarction.” // J.Thorac.cardiovasc.Surg. - 1987.- №94 - p. 566-570. 23. Kitamura S., Kay J.H., Krohn B.G., Magidson O., Dunne E.F. “Geometric and functional abnormalities of the left ventricle with a chronic localized noncontractile area.” // Am.J.Cardiol. - 1973. - №31 - p.701-707. 24. Magovern G.J., Sakert T., Simpson K., Laub G.W., Park S.B., Liebler G., Burkhoider J., Maher T., Benckart D., Magovern G.J. “Surgical therapy for left ventricular aneurysm (A 10 years experience).” // Circulation. - 1989. - №79(I) – p. 102-107. 25. Mickleborough L.L. “Left ventricular aneurysm: modified linear closure technique.” // Operat. techniq. in cardiac thorac. sur. - 1997. – №2 – p. 118-132. 26. Mickleborough L., Maruyama H., Takagi Y. “Results of revascularization in patients with severe left ventricular dysfunction.” // Circulation. - 1995. – №92 – p. II-73-II-79. 27. Mickleborough L.L., Carson S., Ivanov J. “Repair of dyskinetic or akinetic left ventricular aneurysm: results obtained with a modified linear closure.” // J.Thorac.Cardiovasc.Surg. - 2001. – №121 – p. 675-682. 28. Mills N.L., Everson C.T., Hockmuth D.R. “Technical advances in the treatment of left ventricular aneurysm.” // Ann. Thorac. Surg. - 1993. – №55 – p. 792-800 29. Moon M.R., Bolger A.F., DeAnda A., Komeda M., Daughters G.T. “Septal function during left ventricular unloading.” // Circulation. - 1997. – №95 - p. 1320-1327 30. Nelson G.S., Sayed-Ahmed E. Y., Gibbons Kroeker C. A., Yi-Hui Sun “Compression of interventricular septum during right ventricular pressure loading.” // Am. Jour. Physiol. Heart Circ. Physiol. - 2001. – №280 – p. H2639-H2648. 31. Oxelbark S., Mannting F., Ramstrom J. “Surgery for chronic left ventricular aneurysm (Benefits and side effects).” // Scand.J.Thor.Cardiovasc.Surg. - 1993. – №27 – p. 157-164. 32. Rahimtola S.H. “The hibernating myocardium.” // Am. Heart J. - 1989. - №117 - p. 211-221. 33. Soto J., Beller G. “Clinical Benefit of Noninvasive Viability Studies of Patients with Severe Ischemic Left Ventricular Dysfunction.” // Clin. Cardiol. - 2001. – №24 - p. 428-434. 34. Sutton M., Sharpe N. “Left Ventricular Remodeling After Myocardial Infarction. Pathophysiology and Therapy.” // Circulation. - 2000. - №101 - p. 2981-2987. 35. Waller B.F., Rohr T.M., McLaughlin T., Grider L. “Intracardiac thrombi: frequency, location, etiology and complications: a morphologic review- part II.” // Clin.Cardiol. - 1995. - №18 - p. 530-534 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||